阿尔茨海默病新药研发领域充满艰辛、失望和争议,而上月底公布的新药仑卡奈单抗(lecanemab)Clarity AD试验阳性结果,无疑为该领域打了一针强心剂。这项纳入近1800例早期阿尔茨海默病患者的国际多中心、双盲、3期试验达到主要终点和全部关键次要终点,其结果在线发表于《新英格兰医学杂志》(NEJM)。
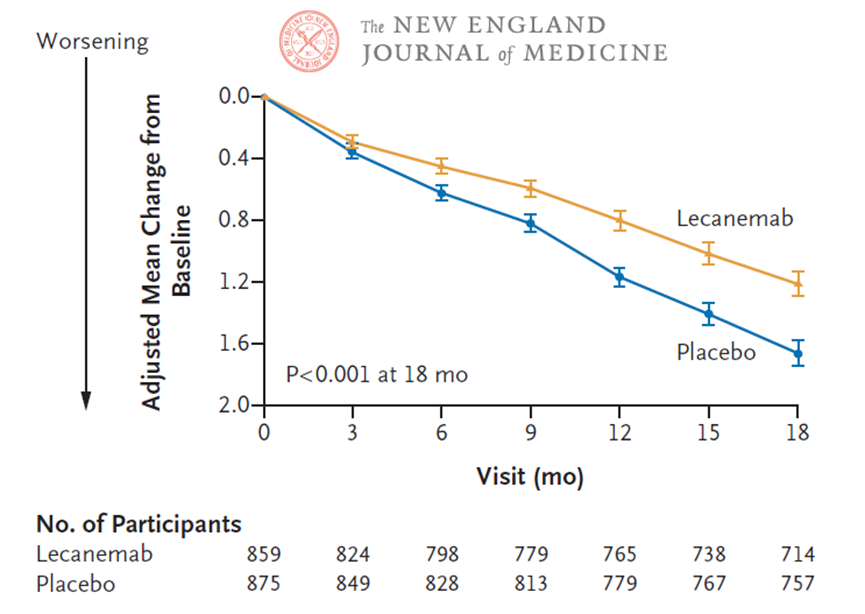
该研究按照1:1随机分组,仑卡奈单抗组患者18个月时认知和功能(CDR-SB量表评分)下降幅度比安慰剂组患者减小27%;阿尔茨海默病的重要生物标志物淀粉样蛋白负荷大幅降低,而安慰剂组则略有升高。这是目前阿尔茨海默病临床试验中取得的最佳结果(当然,不同临床试验之间的结果不能直接比较)。在安全性方面,该组26.4%的参与者出现输液相关反应,12.6%出现淀粉样蛋白相关影像学异常伴水肿或渗出。
仑卡奈单抗可以高亲和力特异结合并清除β淀粉样蛋白(Aβ)可溶性原纤维,而可溶性原纤维已被证明对神经元具有较高毒性。
英国痴呆研究所所长Bart De Strooper认为Clarity AD的成功证明了“阿尔茨海默病可以被治疗“,而美国康奈尔大学医学院神经病学兼职副教授Richard Isaacson称赞仑卡奈单抗掀开了阿尔茨海默病治疗“新篇章“,并表示”对于合适的患者,在合适的剂量和治疗时长下,并且注意监控副作用“,仑卡奈单抗是“可行“并且“重要“的治疗选择。他们都未参与Clarity AD试验。
然而,Clarity AD和仑卡奈单抗也面临质疑。首先,仑卡奈单抗在本试验中尽管使淀粉样蛋白下降,但干预组患者仍然出现认知功能退化,虽然其程度小于对照组。这提示未来可能需要把治疗期提前或者联合其他作用机理的药物治疗才可能显著改善认知功能。其次,仑卡奈单抗组和安慰剂组患者认知下降幅度差异是否具有临床意义?作者在NEJM论文中提示具有临床意义的CDR-SB最小差异尚未确立。第三,仑卡奈单抗药带来的安全性风险是否超过其降低或延缓认知功能下降的获益。
《NEJM医学前沿》在此邀请长期从事阿尔茨海默病诊治和科研的首都医科大学宣武医院神经疾病高创中心主任贾建平教授撰写述评,深入解读Clarity AD研究。阅读NEJM论文翻译,请访问《NEJM医学前沿》官网、APP或点击微信小程序图片。
对基于Aβ学说的阿尔茨海默病又一新药3期临床试验结果的思考
贾建平*,全美娜
首都医科大学宣武医院神经疾病高创中心*
通讯作者
北京时间2022年11月30日,第15届阿尔茨海默病临床试验会议(CTAD)在美国旧金山召开。卫材和渤健公司联合开发的抗淀粉样蛋白β(Aβ)靶向治疗阿尔茨海默病(AD)药物仑卡奈单抗(lecanemab,BAN2401)达到全球3期临床试验(Clarity AD)的主要终点和关键次要终点,研究团队报告了Clarity AD的主要结果,并在《新英格兰医学杂志》(NEJM)在线发表题为“Lecanemab in Early Alzheimer’s Disease”的研究论文[1]。
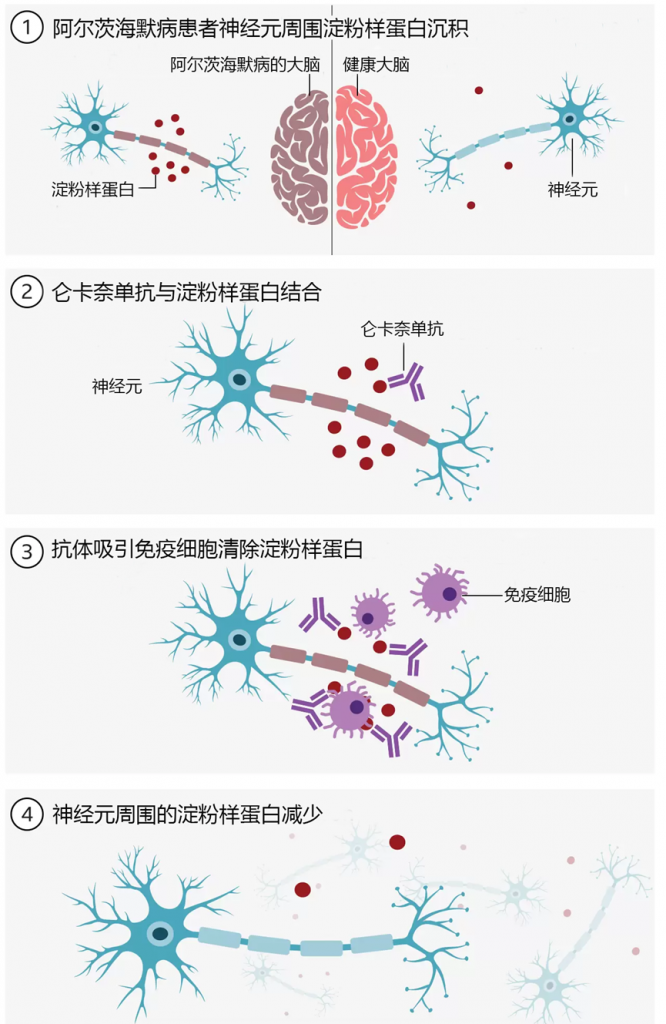
Clarity AD是一项为期18个月的全球多中心、安慰剂对照、双盲、平行、开放期延续的3期临床试验,旨在评估仑卡奈单抗治疗早期AD(包括AD源性的轻度认知障碍[MCI]和轻度痴呆患者)的有效性及安全性。日本、美国、欧洲、中国、韩国、加拿大、澳大利亚和新加坡的235个研究中心纳入了1,795例早期AD患者。值得期待的是,中国也参与了该药的3期临床试验,共收集111例患者,由于中国研究入组开始较晚,临床试验仍在进行中,中国患者结果预计2023年下半年揭晓,以揭示不同人种是否有疗效差异。
在Clarity AD临床试验中,早期AD患者在18个月时间里每两周接受一次静脉注射仑卡奈单抗或安慰剂,研究人员采用痴呆认知评定量表如CDR-SB、ADAS-cog、ADCOMS和ADCS-MCI-ADL等,在用药组获得了比对照组有显著意义的评分,提示仑卡奈单抗明显改善了认知功能,并提示用药的患者进展到疾病下一阶段的可能性要明显降低(31%)。
这一结果受到包括我国在内的世界各国关注。我国有着庞大的痴呆和认知障碍人群,2014年报道痴呆患病率为5.14%,有近1000多万的痴呆患者[2]。2020年痴呆患病率增长到6.04%,约合1500万患者[3],而痴呆和轻度认知障碍人群总数超过5000万[4]。痴呆花费每人每年12万元人民币,年总花费为1万多亿人民币[5],对社会、家庭和个人构成沉重的负担。因此,痴呆的防治成为对社会影响极为广泛的挑战性问题。
自2020年九期一、2021年单抗药物aducanumab(商品名Aduhelm)上市以来,抗AD药物临床试验风起云涌。随着Clarity AD研究结果的正式发表,仑卡奈单抗有望成为药物治疗的新选择,也预示着AD治疗质量将会有新的突破。
Clarity AD的阳性结果还说明Aβ学说在AD发病中不可动摇的地位。2022年7月21日,Science发布一篇历时6个月完成的名为“Blots on a field?”的调查报告[6],针对的是Sylvain Lesné和Karen H. Ashe等人于2006年发表在Nature上名为“A specific amyloid-beta protein assembly in the brain impairs memory”的研究[7]。调查报告指出,Sylvain Lesné在验证Aβ56介导AD小鼠模型记忆丧失中的核心作用的数据时存在明显的数据操纵行为。该报告发布之后,舆论哗然,关于AD“Aβ假说被动摇”的言论层出不穷。
为了准确理解Aβ靶点,让我们首先回顾一下淀粉样蛋白假说的发展历史。1992年,John Hardy等提出了AD发病的淀粉样蛋白级联/瀑布假说并发表在Science [8]。1993年,G. William Rebeck等人发现在AD患者中,约有62%的患者拥有载脂蛋白Eε4(APOE-epsilon 4)等位基因[9]。1997年,Evgeny I. Rogaev等人发现早老素1(PSEN1)与早发性家族性AD相关[10]。以上这三种基因均与Aβ的生成相关[11-13]。另一个间接证据则是唐氏综合征患者体内的APP基因引起了早期脑内的Aβ斑块沉积[14,15]。随后成百上千次的实验结果,包括遗传学、生物化学、细胞学等证据均指向Aβ在AD发病和进展过程中具有极其重要的作用。
Aβ有单体(单个肽单元)、二聚体、三聚体、寡聚体、原纤维和淀粉样蛋白斑块等多种形式。自1998年Mary P. Lambert等人发现Aβ可溶性寡聚体的自发形成以来,Aβ寡聚体的毒性研究就成为AD领域的重要方向,但究竟是何种Aβ寡聚形态导致认知能力下降仍不明确[16]。基于此,Sylvain Lesné等人着眼于找出在AD临床前阶段与认知减退时间点发生同步改变的一种特定的Aβ可溶性寡聚体作为新的靶点,为AD治疗干预提供新的证据。令人遗憾的是,论文中提出的这种关键分子蛋白印迹图片受到质疑。
但Aβ56只是众多Aβ寡聚体的一种,AD病理变化不可能只由一种寡聚体引起,而且到2008年,即Lesné论文发表2年后,AD研究人员确定,支持Aβ56在认知能力下降中作用的发现无法复制。即便该研究结果真实性存在问题,也不能否认其他关于Aβ寡聚体毒性研究的结论。也就是说,不能因为一个Aβ56的问题,就否定整个Aβ寡聚体领域研究的价值,亦不能扩展到对整个Aβ假说的质疑。
目前进行的3期AD临床药物试验中,大约19%(6/31)的药物是基于淀粉样蛋白假说研发的,主要是靶向Aβ斑块、原纤维、寡聚体,或是影响Aβ的形成[17]。靶向Aβ相关的神经元功能障碍仍然是AD领域最有希望的预防和治疗方法之一。
但我们也不能盲目乐观地接受一切靶向Aβ的单克隆抗体药物。实际上,一些关于靶向Aβ药物的国际多中心3期临床试验确实得到了阴性结果。例如,靶向可溶性Aβ寡聚体的药物crenezumab,两周一次静脉注射,长达100周,在早期AD患者中耐受性良好,但未能减少临床进展,也未改变AD相关的生物标志物[18]。已经上市的aducanumab在两个平行的3期临床试验中也未能都获得阳性结果。越来越多的临床研究提示未来AD的预防和治疗要向多靶点、联合用药发展[19],并且越来越重视人群的多样性和异质性[20],以及基因和环境的交互作用[21],从而更好地反映真实世界的情况。
Clarity AD阳性结果公布为整个AD药物研发界带来了很好的消息。能够在众多Aβ研究中脱颖而出,说明其临床试验设计有很多值得肯定之处。例如,该研究的治疗定位在早期(包括AD引起的MCI或轻度痴呆)阶段,为临床早期治疗提供了很好的基础。另外,仑卡奈单抗靶向很明确,对可溶性寡聚体和原纤维具有独特的亲和力,针对AD的病因,把握住了关键环节。
尤其引人关注的是,本研究不仅仅是心理量表的主观评价,还引入了外周生物标志物的评价指标。试验表明在脑脊液中,无论是Aβ还是tau等相关生物标志物在用药组都明显改善,这克服了过去众多临床试验单靠主观心理量表评价的缺点。更难得的是,这些生物标志物和临床量表评分结果显示出良好的一致性。
另一方面,因为纳入患者中含有MCI患者,而MCI是介于AD和正常人群的中间状态,即这些患者既可以恢复正常,也可以进展为AD,因此评判其获益需要更长随访时间。我们欣喜地看到仑卡奈单抗已经在临床前期AD患者中进行更长期研究(AHEAD 3-45,NCT04468659),有望通过更早期治疗和更长时间随访进一步佐证该药物的疾病修饰疗法(DMT)效用。
总之,我们对仑卡奈单抗寄予很大期望,希望在临床实践中获得更多证据,为痴呆患者的治疗提供更多价值。我们期待越来越多的病因修饰治疗AD药物问世。在此,我们也呼吁国家能更重视早期AD的防治,帮助更多的中国患者,减轻疾病带来的负担。
参考文献
1. van Dyck CH, Swanson CJ, Aisen P, et al. Lecanemab in early Alzheimer’s disease. N Engl J Med 2022;DOI: 10.1056/NEJMoa2212948 (E Pub Ahead of Print).
2. Jia J, Wang F, Wei C, et al. The prevalence of dementia in urban and rural areas of China. Alzheimers Dement 2014;10:1-9.
3. Jia L, Du Y, Chu L, et al. Prevalence, risk factors, and management of dementia and mild cognitive impairment in adults aged 60 years or older in China: a cross-sectional study. Lancet Public Health 2020;5:e661-e671.
4. Jia L, Quan M, Fu Y, et al. Dementia in China: epidemiology, clinical management, and research advances. Lancet Neurol 2020;19:81-92.
5. Jia J, Wei C, Chen S, et al. The cost of Alzheimer’s disease in China and re-estimation of costs worldwide. Alzheimers Dement 2018;14:483-91.
6. Piller C. Blots on a field? Science 2022;377:358-63.
7. Lesne S, Koh MT, Kotilinek L, et al. A specific amyloid-beta protein assembly in the brain impairs memory. Nature 2006;440:352-7.
8. Hardy JA, Higgins GA. Alzheimer’s disease: the amyloid cascade hypothesis. Science 1992;256:184-5.
9. Rebeck GW, Reiter JS, Strickland DK, Hyman BT. Apolipoprotein E in sporadic Alzheimer’s disease: allelic variation and receptor interactions. Neuron 1993;11:575-80.
10. Rogaev EI, Sherrington R, Wu C, et al. Analysis of the 5′ sequence, genomic structure, and alternative splicing of the presenilin-1 gene (PSEN1) associated with early onset Alzheimer disease. Genomics 1997;40:415-24.
11. Hardy J. Amyloid, the presenilins and Alzheimer’s disease. Trends Neurosci 1997;20:154-9.
12. Citron M, Westaway D, Xia W, et al. Mutant presenilins of Alzheimer’s disease increase production of 42-residue amyloid beta-protein in both transfected cells and transgenic mice. Nat Med 1997;3:67-72.
13. Kim H, Kim S, Cho B, Shin J, Kim J. APOE epsilon4-dependent effects on the early amyloid pathology in induced neurons of patients with Alzheimer’s disease. Transl Neurodegener 2022;11:45.
14. Teller JK, Russo C, DeBusk LM, et al. Presence of soluble amyloid beta-peptide precedes amyloid plaque formation in Down’s syndrome. Nat Med 1996;2:93-5.
15. Mumford P, Tosh J, Anderle S, et al. Genetic mapping of APP and amyloid-beta biology modulation by trisomy 21. J Neurosci 2022;42:6453-68.
16. Lambert MP, Barlow AK, Chromy BA, et al. Diffusible, nonfibrillar ligands derived from Abeta1-42 are potent central nervous system neurotoxins. Proc Natl Acad Sci U S A 1998;95:6448-53.
17. Cummings J, Lee G, Nahed P, et al. Alzheimer’s disease drug development pipeline: 2022. Alzheimers Dement (N Y) 2022;8:e12295.
18. Ostrowitzki S, Bittner T, Sink KM, et al. Evaluating the safety and efficacy of crenezumab vs placebo in adults with early Alzheimer’s disease: two phase 3 randomized placebo-controlled trials. JAMA Neurol 2022;79:1113-21.
19. Delrieu J, Bateman RJ, Touchon J, Sabbagh M, Cummings J. The future of AD clinical trials with the advent of anti-amyloid therapies: an CTAD Task Force Report. J Prev Alzheimers Dis 2022;9:393-9.
20. Peroutka SJ. Defining demographic cohorts in clinical trial populations using large electronic health records databases. Contemp Clin Trials 2022;121:106890.
21. Migliore L, Coppede F. Gene-environment interactions in Alzheimer’s disease: the emerging role of epigenetics. Nat Rev Neurol 2022;18:643-60.
来源:NEJM医学前沿公众号
